Un medicamento que pacientes con cáncer esperaban para su quimioterapia fue rechazado por fallas de calidad. En lugar de cambiar de proveedor, el Estado volvió a contratar al mismo fabricante cuatro meses después. El nuevo lote también fue declarado defectuoso. Mientras los contratos se anulaban, los tratamientos seguían corriendo contra el reloj.
Se trataba de miles de frascos de ciclofosfamida, producida por el laboratorio indio Kwality Pharmaceuticals y representada en el Perú por DS Pharma. El 15 de julio de 2024, Cenares —la entidad encargada de comprar medicamentos para la red pública— firmó un contrato para adquirir 10 mil unidades de este fármaco usado en terapias contra el cáncer de mama, leucemias y sarcomas.
Dos lotes importados en junio y agosto fueron declarados no conformes tras detectarse partículas extrañas. Cuando el contrato ya estaba en proceso de cancelación por los retrasos, llegó una señal aún más grave: el 18 de setiembre de ese mismo año, la Dirección General de Medicamentos, Insumos y Drogas (Digemid) negó a Kwality Pharmaceuticals el certificado de Buenas Prácticas de Manufactura (BPM) para su planta de oncológicos, lo que significa que no cumplía las condiciones exigidas para fabricar medicamentos seguros.
Con sus envíos de ciclofosfamida observados y la planta sin certificación, lo esperable era que el Estado cortara el vínculo comercial. Pero el 28 de octubre, Cenares firmó un nuevo contrato que incluía al mismo fabricante y para el mismo producto: 25 mil unidades adicionales de ciclofosfamida y otros productos.
Esta segunda compra también fracasó. Los cuatro lotes importados fueron observados por contaminación con partículas visibles. La primera adquisición se anuló en noviembre de 2024. La segunda, en mayo de 2025, cuando el propio importador solicitó resolver el contrato.
Aun así, Kwality logró que un juzgado dictara una medida cautelar que dejó en suspenso la negativa de certificación de su planta de oncológicos. Con esa decisión judicial, la empresa puede seguir vendiendo medicamentos al Estado.
El episodio revela una dinámica en las compras del Ministerio de Salud: a través de Cenares, sigue contratando a fabricantes con antecedentes recientes de fallas sanitarias. La intención es evitar que falten medicamentos. Pero cuando los lotes vuelven a ser observados, las entregas se retrasan y los tratamientos se postergan en pacientes que no pueden esperar.
Una medida vigente hasta 2028
Hoy, más de 250 laboratorios extranjeros que venden medicinas al país operan bajo un esquema excepcional que les permite exportar sin haber sido inspeccionados directamente por la autoridad peruana. De ellos, 27 tienen pendiente la certificación de plantas que producen oncológicos, varias ubicadas en la India.
El origen está en una medida aprobada en 2013. Ante la acumulación de solicitudes y el riesgo de desabastecimiento del mercado interno, el Ministerio de Salud autorizó que laboratorios ubicados en países no considerados de alta vigilancia sanitaria —como India, China, Uruguay o Argentina— pudieran exportar medicamentos presentando únicamente el certificado de Buenas Prácticas de Manufactura (BPM) emitido por la autoridad de su propio país, mientras la inspección quedaba pendiente.
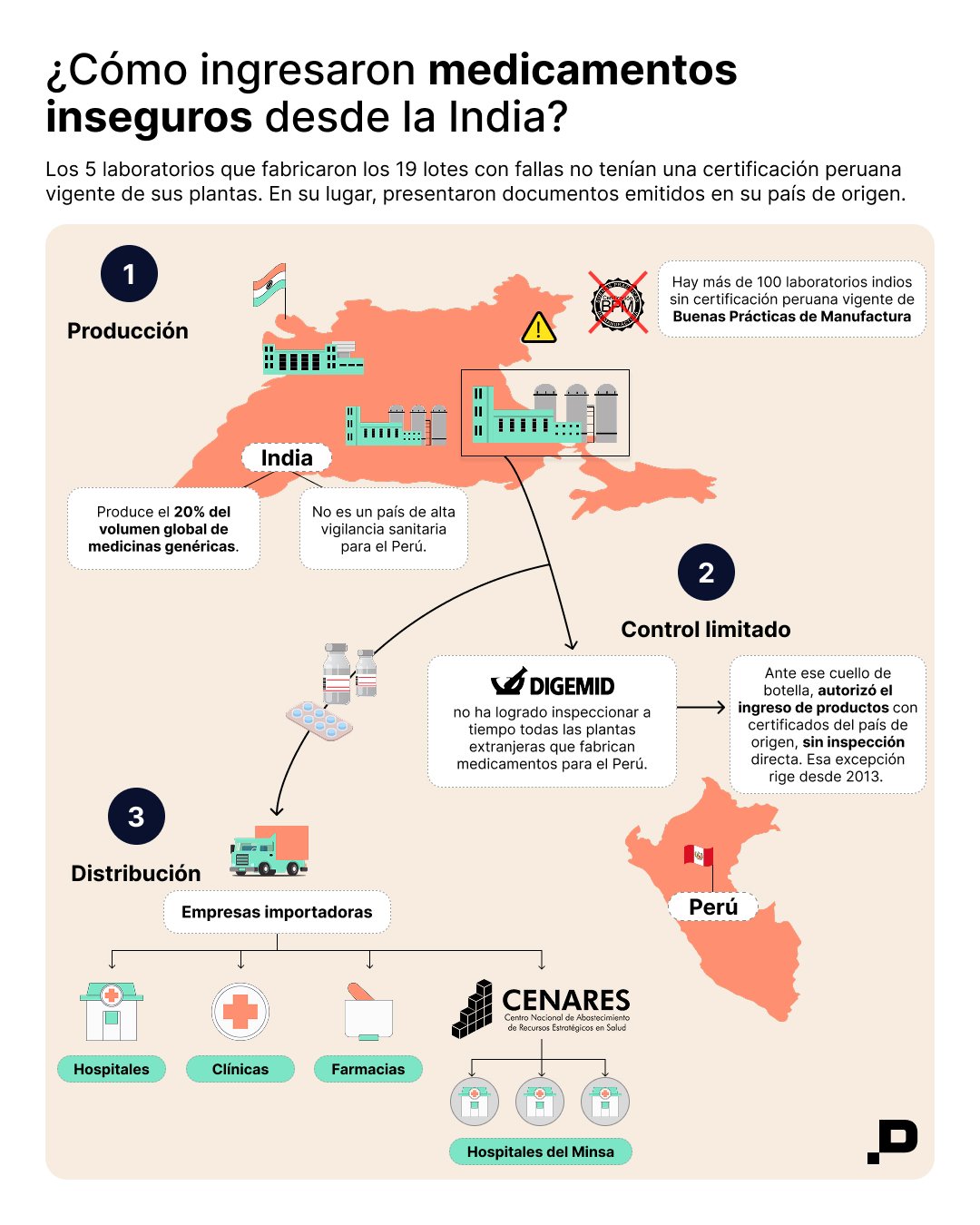
La ley exige que esas plantas sean evaluadas directamente por personal de la Digemid antes de recibir la certificación. Sin embargo, esas visitas casi no se realizan. La entidad carece de capacidad operativa y autonomía presupuestal para sostener ese control, pese a que los laboratorios pagan los trámites y los viáticos correspondientes. El resultado es una larga lista de empresas con inspecciones pendientes.
En esa lista está United Biotech, fabricante indio que ya ha vendido al Ministerio de Salud medicamentos contra el cáncer con fallas de calidad.
En octubre de 2025, la Digemid alertó que un lote de ifosfamida fabricado por United Biotech no era estéril y contenía partículas visibles. Diez mil unidades estaban destinadas a hospitales públicos, pero el contrato con el importador World Drug Pharmaceutical se canceló tras conocerse los resultados.

No era la primera vez. En 2022, North Life Pharma suministró a Cenares 24.000 unidades de ifosfamida del mismo laboratorio por más de medio millón de soles. La mitad no se utilizó por presentar un color inusual y pelusas; el lote de reposición también mostró puntos negros y partículas extrañas.
United Biotech exportó este fármaco para quimioterapia sin contar con certificación vigente de Buenas Prácticas de Manufactura para su planta de oncológicos. Su certificado había vencido el 21 de julio de 2021.
Actualmente, mantiene al menos seis registros sanitarios activos para exportar al país medicamentos esenciales como ifosfamida, ciclofosfamida, cisplatino, doxorrubicina y metotrexato.
Otro caso es el del laboratorio Beta Drugs. La Digemid le otorgó la certificación recién en setiembre de 2025. Cuatro meses antes, cuando la planta aún no contaba con ese reconocimiento, al menos cuatro lotes de cisplatino vendidos para los hospitales del Ministerio de Salud generaron alertas sanitarias por fallas de calidad y fueron destruidos.

Aun con estos antecedentes y las alertas acumuladas en los últimos años, la exoneración de la inspección peruana a laboratorios extranjeros—que nació como una medida excepcional— se ha prorrogado de manera continua. La norma vigente extiende ese esquema hasta mayo de 2028.
Hace tan solo unos meses quedó en evidencia una de sus consecuencias más graves. El sedante Edetoxin, contaminado con la bacteria Ralstonia pickettii, afectó a 28 pacientes en estado crítico —entre ellos bebés— en el Instituto Nacional de Salud del Niño de San Borja y en otros establecimientos. El medicamento, utilizado en unidades de cuidados intensivos, fue fabricado por el laboratorio indio Farbe Firma, cuya planta estaba en lista de espera para ser inspeccionada por la Digemid.
Suspensiones tardías
Después del caso del Edetoxin, las autoridades sanitarias tuvieron que corregir otra debilidad del sistema de control. Hasta entonces, cuando un laboratorio extranjero no aprobaba la certificación de Buenas Prácticas de Manufactura (BPM), se impedía la importación de nuevos lotes, pero los productos que ya estaban en el país podían seguir distribuyéndose hasta agotar el stock.
En octubre de 2025, la Digemid cambió ese criterio y comenzó a suspender los registros sanitarios de medicamentos fabricados por plantas desaprobadas. Hasta el 22 de enero de 2026, había suspendido 297 registros.

Para el químico farmacéutico Javier Llamoza, vocero de Acción Internacional para la Salud, el cambio llegó tarde:
—Si la autoridad niega el certificado es porque encontró fallas en la planta. Durante años eso no significaba retirar los lotes que ya estaban circulando. Recién después de casos graves se empezó a cambiar ese criterio, cuando el riesgo para los pacientes ya había quedado claro.
Entre los laboratorios con registros sanitarios suspendidos identificamos 44 vinculados a medicamentos contra el cáncer. Se fabricaban en Uruguay, Argentina, India y Brasil e incluían 24 principios activos, como docetaxel, metotrexato, ifosfamida y doxorrubicina.
Medifarma concentra la mayor parte de estos casos. Tenía 18 medicamentos producidos por Fármaco Uruguayo, cuya planta desaprobó la certificación en diciembre de 2023. Un mes antes, el 8 de noviembre, la Digemid había alertado que un lote de citarabina —hoy con registro suspendido— estaba contaminado con partículas extrañas.
La empresa también arrastra otros antecedentes. En marzo de 2025, un lote de suero fisiológico con exceso de sodio, elaborado en una de sus plantas en Perú, ocasionó la muerte de siete personas.
Perulab también aparece entre las empresas con más suspensiones. Tiene siete registros de medicamentos contra el cáncer retirados, entre ellos abiraterona, metotrexato, capecitabina y erlotinib. Todos fueron fabricados por el laboratorio argentino Kemex, que en octubre de 2024 no obtuvo la certificación de Buenas Prácticas de Manufactura.
En la misma situación está Blau Farmacéutica Perú, a la que se le retiraron cinco registros de medicamentos que contienen gemcitabina, irinotecán, dacarbazina y metotrexato. Estos productos provenían del laboratorio brasileño Blau Farmacêutica, cuya certificación fue negada en octubre de 2023.
DS Pharma Perú también fue incluida en la lista. La empresa tenía cinco registros sanitarios suspendidos correspondientes a productos fabricados por el laboratorio indio Kwality Pharmaceuticals. Se trata del mismo importador y fabricante con los que el Ministerio de Salud contrató de manera reiterada, pese a que en un mismo año le vendieron dos veces un medicamento oncológico con fallas de calidad.
Sin embargo, a diferencia de otros casos, la empresa logró mantener vigentes sus registros mediante una medida cautelar. Si este mecanismo se replica en otras compañías, el control sanitario queda sujeto a resoluciones judiciales temporales y la seguridad de los pacientes deja de estar en el centro.
El Estado se multó a sí mismo por un medicamento defectuoso
Un extrabajador de Cenares, que pidió mantener su identidad en reserva, contó que los análisis de medicamentos que compra el Estado pueden tardar entre tres y cuatro meses en un laboratorio acreditado en el Perú. En ese tiempo, dijo, a veces se distribuyen antes de que concluyan las pruebas para no dejar sin stock a los servicios de salud.
—Nos llegaba la orden de repartirlos y teníamos que hacerlo. Después se sabía que no habían pasado los controles de calidad.
Esto ocurrió en enero de 2020. Para no interrumpir tratamientos de tuberculosis, el Ministerio de Salud pidió exonerar del control de calidad 14.300 tabletas de linezolid. El lote, fabricado por Zenith Healthcare en la India, formaba parte de una compra mayor realizada por Cenares.
Meses después, cuando el medicamento ya se había usado, se supo que no cumplía con el ensayo de disolución. La Digemid sancionó a Cenares con una multa de S/ 46.000. Fue una entidad del Estado la que multó a otra.